
Tryptophan
Tryptophan – Der Vorläufer des „Glückshormons“ Serotonin
Wer kennt das nicht, ein harter Tag auf der Arbeit und die Nerven sind bereits gut beansprucht worden. Aber egal, wer ein guter Bodybuilder sein will, der geht trainieren. Egal, was kommt. Also was tun, wenn man sich schlapp und ausgepowert fühlt?
Genau, wozu gibt es denn Trainingsbooster, die einen nochmal so richtig pushen können. Das Training ist jetzt absolviert und der Trainingsbooster hat alles von einem abverlangt und die Nerven liegen jetzt endgültig blank. Man ist ausgepowert und fühlt sich so richtig schlapp, und dazu noch dieser unbändige Hunger nach etwas Süßem, was tun?
Eine einfache Aminosäure namens „Tryptophan“ kann hier durchaus weiterhelfen. Dieser Artikel wird sich um diese unscheinbare Aminosäure drehen. Es wird die Geschichte sowie die biochemische Rolle von Tryptophan thematisiert. Weitere wichtige Aspekte sind das Vorkommen in Lebensmitteln und wie es im Sport eingesetzt werden kann. Anschließend werfen wir noch einen Blick über den Tellerrand hinaus, in den Bereich der Medizin und Psyche, wo Tryptophan ebenfalls eingesetzt wird.
1. Allgemeines zu Tryptophan
Tryptophan ist eine Aminosäure, welche sowohl im tierischen als auch im pflanzlichen Bereich vorzufinden ist. Von den 20 proteinogenen Aminosäuren, welche für einen reibungslosen Ablauf in unserem Organismus vonnöten sind, werden 11 Aminosäuren zu den nicht-essentiellen (entbehrlichen) und 9 Aminosäuren zu den essentiellen (unentbehrlichen) Aminosäuren gezählt. Entbehrlich heißt: Unser Körper ist in der Lage, diese Aminosäuren mittels biochemischer Abläufe selbst zu synthetisieren und die unentbehrlichen Aminosäuren müssen über die Nahrung von außen zugeführt werden.
Tryptophan ist eine solche und wird somit zu den unentbehrlichen Aminosäuren gezählt. Von allen 20 Aminosäuren ist die Tryptophankonzentration im menschlichen Organismus am niedrigsten. Die vorhandenen Speicher haben hier nur begrenzte Reserven. Des Weiteren ist Tryptophan ein sogenanntes Provitamin der Nicotinsäure, die auch Niacin (Vitamin B3) genannt wird. Zudem ist sie eine extrem wichtige Aminosäure, da sie als Ausgangssubstrat und somit für die Biosynthese des Neurotransmitters Serotonin, bzw. des Hormons Melatonin, dient. Serotonin wird landläufig auch als das „Glückshormon“ und Melatonin als „Schlafhormon“ bezeichnet.
2. Geschichte und Entdeckung
Die Aminosäure Tryptophan wurde erstmals von dem Biochemiker Frederick Hopkins im Jahre 1901 entdeckt. Er isolierte mittels Hydrolyse erfolgreich das Tryptophan aus dem Casein (Hopkins et al., 1901).
3. Biochemische Rolle von Tryptophan
3.1 Chemische Strukturen
Bei Tryptophan C11H12N2O2 (TrP) handelt es sich in seiner L-Form um eine proteinogene Aminosäure. Das besondere Merkmal dieser Aminosäure ist ihr aromatischer Idolring. In der Chemie lautet ihre genaue Bezeichnung 2-Amino-3-(1H-indol-3-yl)propansäure. Zu ihren chemischen Eigenschaften gehört, dass sie nicht wasserlöslich und dazu noch extrem hitzebeständig ist.
3.2 Bedarf von Tryptophan
Bei einer normalen ausgewogenen Kost geht man von einer durchschnittlichen täglichen Verzehrmenge von 1 bis 1,5 g Tryptophan aus (Benedict et al., 1983; Richard et al., 2009). Da Tryptophan sowohl in tierischen wie auch in pflanzlichen Lebensmitteln reichlich enthalten ist, besteht sogar bei den Vegetariern oder gar Veganern keine Mangelversorgung an dieser Aminosäure. Tryptophan ist in vielen pflanzlichen Lebensmitteln ausreichend enthalten.
Der tägliche Bedarf an Tryptophan eines Normalbürgers wird mit ca. 250 mg veranschlagt. Wie bereits oben erwähnt, ist Tryptophan das Provitamin von Niacin (Vitamin B3).
Allerdings gilt es hier zu wissen:
Um 1 mg Niacin zu erhalten, müssen dazu 60 mg Tryptophan verwertet werden. Eine direkte Einnahmeempfehlung für das Tryptophan ist bis heute von der Deutschen Gesellschaft für Ernährung (DGE) noch nicht herausgegeben worden. Jedoch dürften die empfohlenen Dosierungen je nach Sportart dementsprechend höher ausfallen.
Die DGE hat lediglich eine Zufuhrempfehlung für das Niacin herausgegeben, die hier exemplarisch dargestellt wird.
| Empfohlene Zufuhr von Niacin1 | ||
| Alter | männlich | weiblich |
| Säuglinge | ||
| 0 bis unter 4 Monate2 | 2 mg | |
| 4 bis unter 12 Monate | 5 mg | |
| Kinder und Jugendliche | ||
| 1 bis unter 4 Jahre | 8 mg | |
| 4 bis unter 7 Jahre | 9 mg | |
| 7 bis unter 10 Jahre | 11 mg | 10 mg |
| 10 bis unter 13 Jahre | 13 mg | 11 mg |
| 13 bis unter 15 Jahre | 15 mg | 13 mg |
| 15 bis unter 19 Jahre | 17 mg | 13 mg |
| Erwachsene3 | ||
| 19 bis unter 25 Jahre | 16 mg | 13 mg |
| 25 bis unter 51 Jahre | 15 mg | 12 mg |
| 51 bis unter 65 Jahre | 15 mg | 11 mg |
| 65 und älter | 14 mg | 11 mg |
| Schwangere ab dem 4. Monat | 14 mg | |
| Stillende | 16 mg | |
| 1 1 mg Niacin – Äquivalent = 60 mg Tryptophan 2 Hierbei handelt es sich um einen Schätzwert 3 Zugrunde gelegt wurde die entsprechende Tabelle zur Energiezufuhr (http://www.dge.de/wissenschaft/referenzwerte/energie/) |
||
3.3 Biosynthese von Tryptophan
Die Gewinnung von Tryptophan ist dem menschlichen Körper nicht möglich. Somit ist eine Zufuhr von außen unumgänglich. Die Herstellung dieser Aminosäure ist lediglich den Pflanzen und Mikroorganismen z. B. aus der Shikimisäure bzw. der Anthranilsäure vorbehalten. Aufgrund des komplexen Synthesevorganges von Tryptophan werden in diesem Artikel nur die wichtigsten Punkte aufgezählt.
Für die Entstehung des Tryptophans werden neben der Anthranilsäure weitere Substrate benötigt. Die Umwandlung der Anthranilsäure in das Tryptophan wird dabei in mehreren Teilschritten vollzogen. Im letzten Schritt wird dann aus Indol und Serin Tryptophan gebildet.
3.4 Tryptophan als Ausgangsstoff für die Neurotransmitter- und Hormonherstellung
Wie in der allgemeinen Einleitung von Tryptophan schon beschrieben, ist diese unscheinbare Aminosäure ein zentraler Kern (Ausgangssubtrat) für die körpereigene Synthese des Neuro-transmitters Serotonin und des Hormons Melatonin. Oder anders gesagt, kein Tryptophan = kein Serotonin und kein Melatonin.
3.5 Die Blut-Hirn-Schranke (BHS)
In vielen Artikeln und Fachzeitschriften fällt oft im Zusammenhang mit Hormonen, Neurotransmittern, Fetten, Vitaminen und weiteren Substraten der Begriff der Blut-Hirn-Schranke (BHS). Da dieser Artikel sich um Tryptophan dreht, werden wir hier nur die für uns wichtigsten Aspekte herausarbeiten und näher erläutern.
| Kurze Erläuterung: Zwischen 80 und 90 % des Tryptophans sind an Eiweiß gebunden und können die Blut-Hirn-Schranke nicht überwinden. Nur freies Tryptophan kommt durch die Blut-Hirn-Schranke hindurch. |
Wie es der Name schon selbst aussagt, handelt es sich bei der Blut-Hirn-Schranke um eine im Gehirn vorhandene physiologische Schranke, welche sich zwischen dem Kreislauf des strömenden Blutes und dem des Zentralnervensystems befindet (ZNS). Diese Schranke bestimmt, welche Substrate (Moleküle, Zellen etc.), die sich im Blutkreislauf befinden, in das Hirngewebe übertreten dürfen.
Diese Schranke besteht aus folgenden Komponenten:
- Kapillarendothelzellen
- Basalmembran
- Astrozyten
- Perizyten
Hier ist anzumerken, dass die Endothelzellen durch die tight junction fest miteinander verwachsen sind. Sie sind der Hauptakteure der Blut-Hirn-Schranke und somit die eigentliche Barriere.
Damit man versteht, um welche Dimensionen es sich handelt, hier die Fakten zu den Endothelzellen:
- Gesamtoberfläche ca. 10 – 30 m2
- Gesamtoberfläche ca. 10 – 30 m2
- Gesamtlänge mehr als 600 km
3.6 Tight Junction (engl. "dichte Verbindung")
Wie schön an der Grafik zu sehen ist, beschreiben die Tight Junction nichts anderes als die feste Zellverbindung (Zell-Zell-Verbindung) zwischen den einzelnen Endothelzellen.
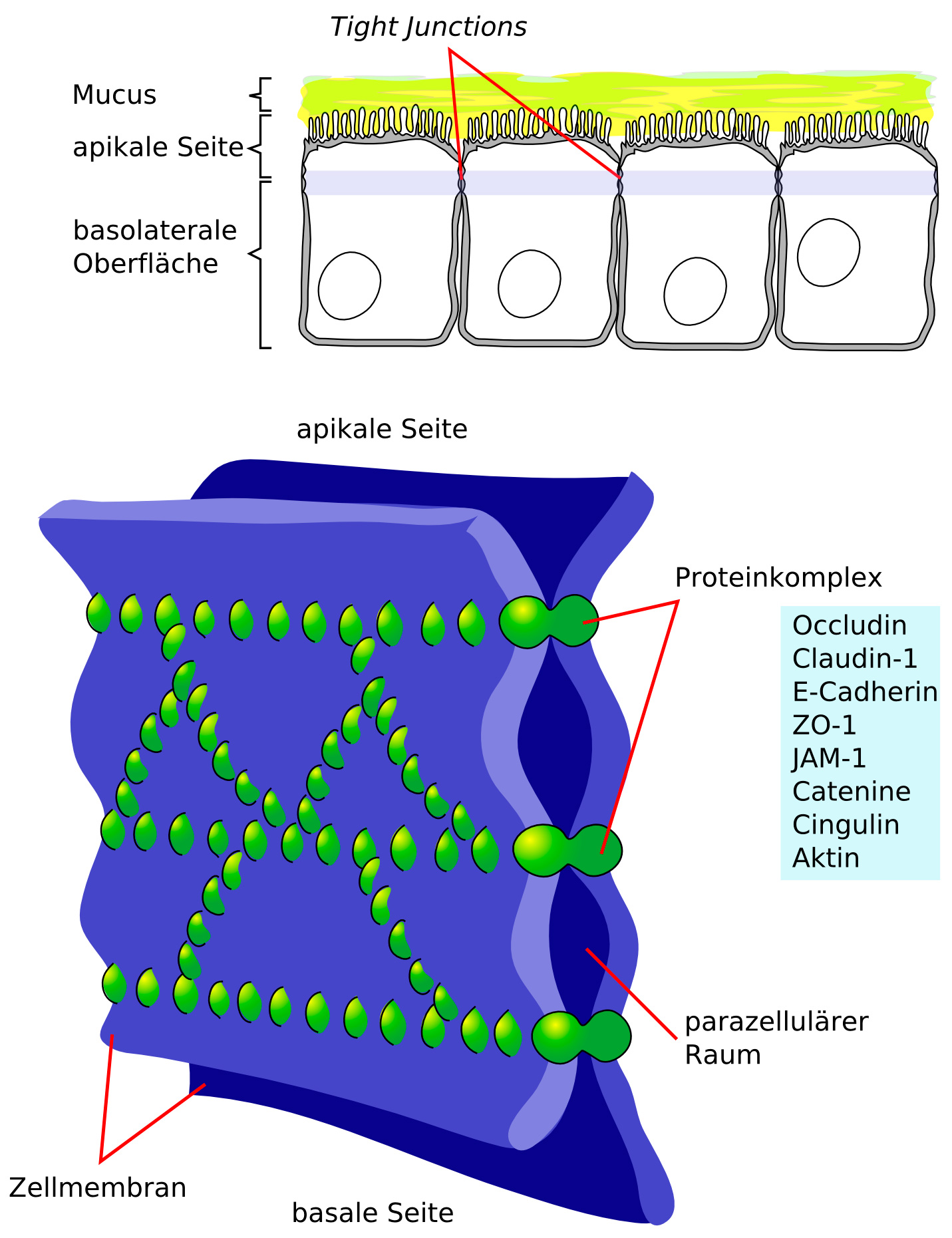 Grafische Darstellung Tight Junction
Grafische Darstellung Tight Junction
Die Blut-Hirn-Schranke soll das Gehirn vor allen Stoffen (Gifte, Drogen, Bakterien, Parasiten etc.) schützen und so eventuelle Schäden im Vorfeld abwenden.
Die Blut-Hirn-Schranke besitzt hier ein Raster, welches nur bestimmte Moleküle mit besonderen Eigenschaften durchlässt, wie z.B.:
- Für hydrophile Moleküle, die größer sind als Molekülmasse 90 g/mol, Molekülradius 0,2 nm, gibt es keinen Durchlass.
- Moleküle mit spezifischem oder unspezifischem Rezeptor (der Rezeptor bestimmt, ob ein Zugang gewährt wird oder nicht).
- Bisher noch unbekannte Faktoren.
3.7 Neurotransmitter
Bei Neurotransmittern handelt es sich um biochemische Botenstoffe, welche in verschiedenster Art und Weise in unserem Körper vorkommen. Der ursprüngliche Name leitet sich von dem altgriechischen Wort für „neuro, Sehne, Nerv“ ab. Ihre Aufgabe ist es, Reize (Informationen) von einer Zelle auf eine andere Nervenzelle zu übermitteln. Dies geschieht mittels einer Präsynapse eines Nervs, welcher die Information abgibt und mittels des Botensstoffes auf die Postsynapse der jeweiligen Zielzelle überträgt. Die übermittelten Informationen werden dann auf physischer oder psychischer Ebene verarbeitet. Dabei ist ein Gleichgewicht zwischen den Neurotransmittern für eine reibungslose Funktion/Homöostase entscheidend.
Aufgrund ihrer chemischen Struktur werden sie dabei wie folgt eingeteilt:
- Biogene Amine – Acetylcholin, Adrenalin, Noradrenalin, Dopamin, Serotonin, Histamin
- Aminosäuren –Aspartat, Glutamat, Glycin, Gaba
- Nukleotid – ATP
- Peptide – z.B. Opioide
4. 5-HTP – Alternative zu Tryptophan?
Wie wir bereits wissen, ist Tryptophan das Ausgangssubstrat für den Neurotransmitter „Serotonin“, welches auch als das Glückshormon bezeichnet wird. Dies geschieht über mehrere Zwischenschritte, aber auf dem Weg dorthin gibt es ein interessantes Zwischenprodukt, das wir uns kurz näher anschauen werden.
Nachdem man Tryptophan zu sich genommen hat, wird durch einen enzymatisch chemischen Vorgang 5-Hydroxythryptophan (5-HTP) gebildet. Oder anders ausgedrückt, 5-HTP ist nichts anderes als ein Derivat der Aminosäure Tryptophan und somit eine direkte Vorstufe des Neurotransmitters Serotonin.
Wir werden uns einen kurzen Überblick darüber verschaffen, welche Unterschiede es zwischen den beiden Aminosäuren gibt und klar darstellen wieso 5-HTP keine Alternative zu Tryptophan ist. Die Blut-Hirn-Schranke verfügt, wie oben beschrieben, über ein gewisses Raster, was sie durchlässt und was nicht. 5-HTP wird gut über die Blut-Hirn-Schranke im Gehirn aufgenommen und benötigt gegenüber dem freien Tryptophan keinen Transporter und wird komplett zu Serotonin umgewandelt. Der Vorgang der Umwandlung findet auch wesentlich schneller als beim freien Tryptophan statt. Derweil scheint es seit einiger Zeit in der Diskussion zu sein, inwieweit 5-HTP bei der Behandlung bei depressiven Menschen eingesetzt werden kann.
Leider sind die bisher gewonnen Daten zu 5-HTP mehr als dünn und es fehlt an qualitativen, überzeugenden und kontrollierten Studien (van Hiele 1980). Ein wichtiger und vor allem entscheidender Nachteil des 5-HTP gegenüber dem Tryptophan ist es, das es nicht nur innerhalb des Gehirns zu Serotonin umgewandelt wird, sondern auch in der Peripherie wie z.B. im Magen-Darm-Trakt. Es kommt zu einem unkontrolliert hohen Serotoninspiegel, welcher u.a. Erbrechen, Übelkeit und Appetitlosigkeit verursachen kann.
Neben den genannten Vorteilen der Synthese muss hier klar gesagt werden, wer es in Betracht zieht, 5-HTP einmal auszuprobieren, der wird den Gang zum Arzt antreten müssen, da 5-HTP in Deutschland ein verschreibungspflichtiges Medikament ist.
Abschließend gibt es noch zu sagen, dass selbst der Verzehr von 1,5 g Tryptophan als unkritisch angesehen werden kann und gut verträglich ist (Young 1986). Dagegen sieht es bei 5-HTP in den Studien ganz anders aus, hier kam es bereits nach der Einnahme von 50 – 100 mg zu Übelkeit. Wurden in Studien höhere Dosierungen verwendet, kam es reihenweise zu einem Abbruch der Therapie, aufgrund von besagten Nebenwirkungen (Smarius et al., 2008).
4.1 Serotonin
Kommen wir nun endlich zum Serotonin, welches auch 5-Hydroxytryptamin, 5-HT oder Enteramin genannt wird. Serotonin selbst ist ein anorexigener Neurotransmitter (HAMANN et al., 2001; SCHUSDZIARRA und ERDMANN, 2010). Seinen Ursprung hat Serotonin in den Neuronen des Gehirnes, genauer gesagt des Nuclei raphes des Gehirnstammes. Diese Neuronen erstrecken sich wiederum über das ganze zentrale Nervensystem (ZNS) (ROCKSTROH, 2001; MEISTER, 2007; LAM et al., 2010). Die Serotoninsynthese findet in vielen Zellen des menschlichen Organismus statt, wobei gerade mal 1 – 2% im Gehirn vorzufinden sind. Der Hauptanteil von Serotonin, etwas 90 %, befindet sich in den enterochromafinnen Zellen des Gastrointenaltrakt, was in etwa 10 mg entspricht. Selbst die Thrombozyten (Blutplättchen) enthalten einen gewissen Anteil an Serotonin. Als Neurotransmitter hat Serotonin mannigfaltige Aufgaben im Gehirn, es beeinflusst unter anderem das Essverhalten, die Körpertemperatur, den Schlaf, das Schmerzempfinden, die Sexualität, den Kreislauf sowie die allgemeine Stimmungs- und Bewusstseinslage (ROCKSTROH, 2001).
4.2 Melatonin
Neben dem Zwischenprodukt 5-HTP und dem Endprodukt Serotonin ist der Körper in der Lage, dass Hormon Melatonin zu synthetisieren. Das Melatonin ist auch als das „Schlafhormon“ bekannt und wird in der Zirbeldrüse gebildet. Hartmann führte 1982 eine Studie durch, bei dem die Probanden zwischen 1 – 1,5 g Tryptophan erhielten. Er kam zu dem Ergebnis, dass es nach ca. 30 Minuten nach dem Verzehr von Tryptophan zu einem erhöhten Melatoninausstoß kam. Dies ist aber nur der Fall, wenn der Lichteinfall gering ist, ansonsten wird dieser Vorgang durch das Licht gehemmt. Je dunkler es wird, desto mehr steigt die Produktion und Ausschüttung des Melatonins an. Hier wird mittels eines biochemischen Zwischenschrittes aus dem Neurotransmitter Serotonin das Hormon Melatonin synthetisiert. Sollte allerdings nach Einnahme von Tryptophan eine sportliche Aktivität ausgeführt werden, wird die schlafanstoßende Eigenschaft vollständig zunichtegemacht.
4.3 Zwischenresümee
Als Zwischenfazit bleibt festzuhalten, dass:
- Tryptophan ein Provitamin des Niacin (Vitamin B3) ist.
- aus Tryptophan das Zwischenprodukt 5-HTP synthetisiert werden kann.
- Tryptophan der zentrale Ausgangsstoff für den Neurotransmitter Serotonin und das Hormon Melatonin ist.
5. Tryptophan in Lebensmitteln
5.1 Vorkommen in Lebensmitteln
Da Tryptophan wie viele andere Aminosäuren ein fixer Bestandteil von Eiweiß ist, ist die Auswahl an Nahrungsmitteln dementsprechend groß. Jedoch muss dazu gesagt werden, dass Tryptophan ausschließlich proteingebunden in der Natur vorkommt.
Die dargestellte Tabelle gibt uns einen kleinen Einblick, wo das Tryptophan überall enthalten ist. Des Weiteren wurde der prozentuale Anteil von Tryptophan gemessen am Gesamtprotein mit angegeben.
| Lebensmittel pro 100g | Gesamtprotein | Tryptophan | Anteil |
| Sojabohnen | 36,49 g | 590 mg | 1,6 % |
| Cashew-Kerne | 18,22 g | 287 mg | 1,6 % |
| Kakaopulver, ungesüßt | 19,60 g | 293 mg | 1,5 % |
| Haferflocken | 13,15 g | 182 mg | 1,4 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 46 mg | 1,4 % |
| Hähnchenbrustfilet, roh | 21,23 g | 267 mg | 1,3 % |
| Hühnerei | 12,57 g | 167 mg | 1,3 % |
| Reis, ungeschält | 7,94 g | 101 mg | 1,3 % |
| Erbsen, getrocknet | 24,55 g | 275 mg | 1,1 % |
| Schweinefleisch, roh | 20,95 g | 220 mg | 1,1 % |
| Walnüsse | 15,23 g | 170 mg | 1,1 % |
| Erdnüsse | 26,12 g | 320 mg | 1,2 % |
| Mais-Vollkornmehl | 6,93 g | 49 mg | 0,7 % |
6. Einsatz im Sport
Nach all der grauen Theorie über u.a. die Synthese der einzelnen Substrate bzw. Neurotransmitter und Hormone, kommen wir nun zum praktischen Teil und klären, wie Tryptophan eingesetzt werden kann.
7. Generierung der maximalen Tryptophanaufnahme
Da Tryptophan nun mal nicht die einzige Aminosäure im menschlichen Organismus ist, welche im Blutkreislauf herumschwimmt, kann es durchaus passieren, dass Tryptophan mit anderen Aminosäuren in einen Konkurrenzkampf tritt. Da diese Aminosäuren:
- Phenylalanin,
- Tyrosin,
- Valin, Leucin und Isoleucin (BCAAs),
um den gleichen Transporter konkurrieren, welcher sich an der Blut-Hirn-Schranke (BHS) befindet. Hier wäre es sinnvoll, die Aminosäuren so zu timen, dass ein dementsprechend langer Zeitraum zwischen den jeweiligen Einnahmen liegt.
Möller 1985 und Kaneko et al., 1992 konnten diesbezüglich in ihren Studien feststellen, dass bei depressiven Patienten ein niedriges Verhältnis der Aminosäure Tryptophan zu den konkurrierenden Aminosäuren vorhanden war. Um eine maximale Tryptophan-Aufnahme zu generieren, scheinen demnach ein hoher Gesamttryptophanspiegel und eine niedrige Konzentration der konkurrierenden Aminosäuren (BCAA, LNAA → Large Neutrals) vonnöten zu sein. Dementsprechende Studien, durchgeführt von Green et al., im Jahre 1980, deuten darauf hin, dass mindestens 1 – 1,5 g Tryptophan pro Einzeldosis gegeben werden müssen, um hohe Tryptophankonzentration an der BHS zu erreichen.
8. Tryptophan und die körperliche Ausdauerleistung
Wie bereits unter 4.1 erklärt, konkurriert das Tryptophan mit den BCAAs am gleichen Carrier an der BHS. HOLLMANN und STRÜDER, 2009 stellten diesbezüglich bei ihren Studien fest, dass bei anhaltender Ausdauerbelastung der BCAA-Spiegel im Blut sank und dem Tryptophan wahrscheinlich die Möglichkeit gegeben wurde, verstärkt die BHS zu überqueren.
9. Tryptophan und die Körperzusammensetzung
Im Jahre 2014 führten die Wissenschaftler Ruan Z. et al., Forschungen mit der Aminosäure Tryptophan an Ratten durch. Ziel der Studie war es, herauszufinden, welchen Einfluss das Tryptophan auf die Körperzusammensetzung haben könnte. Dabei wurden die Ratten in 2 Gruppen eingeteilt:
- Gruppe 1 – Placebo (Kochsalzlösung) für 7 Tage
- Gruppe 2 – 200 mg/kg Tryptophan für 7 Tage
Nach Beendigung der Studie und Auswertung aller Daten kamen sie zu folgendem Ergebnis: Bei der Gruppe Ratten, die das Tryptophan erhielt, konnte eine gesteigerte Proteinsynthese und eine Reduzierung der Fettmasse festgestellt werden. Die dazugehörige Grafik der Studie ist unten zu sehen.
Inwiefern diese Studienergebnisse auf den Menschen übertragbar sind, ist noch ungewiss und muss näher untersucht werden.
10. Tryptophan, Schlaf und Regeneration
Ein weitverbreitetes Problem, welches zahlreiche Bürger plagt, ist die Schlafstörung. Immer mehr Bundesbürger können nur beschwerlich oder nur unter Zuhilfenahme von Schlafmitteln einschlafen. Laut den Berechnungen der Techniker Krankenkasse litten etwa 3,8 Millionen Deutsche im Jahre 2011 an Schlafstörungen. Aber es muss nicht immer gleich der Griff zur chemischen Keule sein, um seinen wohlverdienten Schlaf nach einem anstrengenden Training zu bekommen. Neben einem ausgeklügelten Trainingsplan und ein bis auf die letzte Kcal berechneter Ernährungsplan, ist ein langer und vor allem erholsamer Schlaf eine wichtige Komponente, um seinem Ziel, mehr Muskelmasse aufzubauen, näher zu kommen. In der Zeit, in der Sie ruhen, finden wichtige Prozesse für den Körper und das Gehirn statt, dazu gehören u.a. die Adaptionen im Muskel- und Gehirngewebe.
Biochemische Regelungen für die Proteinsynthese und noch viele weitere Vorgänge werden ausschließlich in der nächtlichen Regenerationsphase durchlaufen. Forscher des Naval Health Research Centers waren daran interessiert, inwiefern eine zusätzliche Tryptophansupplementierung den Probanden hilft, leichter einzuschlafen und die Qualität während des Schlafes zu verbessern.
Die Studie ist im Jahre 1983 mit 15 Männern und 5 Frauen durchgeführt worden. Sie erhielten einmal um 9 Uhr morgens und um 13 Uhr nachmittags eine Dosis von je 4 g L-Tryptophan. Nach 75 Minuten des Verzehrs der Tabletten wurden die Spitzenwerte der Aminosäureebene gemessen, das war der Zeitpunkt, wo die Probanden in einen abgedunkelten Raum gehen mussten, um sich 1 Stunde hinzulegen. Die Zeit, die die Probanden benötigten, um einzuschlafen, war nur halb so lang wie vorher. Die Wissenschaftler mutmaßten, dass dieser Effekt mit dem Tryptophan als Ausgangssubstanz für Serotonin zu tun hat.
11. Mangelerscheinungen von Tryptophan
Schon der deutsche Philosoph und Anthropologe Ludwig Andreas Feuerbach sagte, „Der Mensch ist, was er isst“, damit hatte er bereits mehr recht, als er es zu sich zu seinen Lebzeiten hätte träumen lassen. Da wir ja wissen, dass Tryptophan eine essentielle Aminosäure ist, welche wir verzehren müssen, die dann anschließend zu Serotonin umgewandelt wird, kann ein Mangel an dieser Aminosäure fatale Folgen für unser Gefühlsleben und unsere Physiologie haben.
Darunter können folgende Symptome auftreten:
- psychische Störungen (Aggressivität, erhöhtes Angstempfinden, Depressionen, vermindertes Selbstwertgefühl)
- Schlafstörungen
- Störungen der kognitiven Leistung
- verminderte Schmerzwahrnehmung
- Störungen des Proteinstoffwechsels (Proteinkatabolismus)
12. Supplementierung
12.1 Anwendung in der Praxis
Tryptophan sollte möglichst immer nach folgendem Einnahmeschema verzehrt werden.
- Die Einnahme sollte auf nüchternen Magen (ca. 2 Stunden vorher nichts gegessen) erfolgen.
- Tryptophan sollte möglichst immer als Monosupplement verzehrt werden (Konkurrenzverhalten BHS).
- ca. 1,5 – 2,5 g Tryptophan in etwa 30 – 60 Minuten vor dem Schlafengehen.
12.2 Nebenwirkungen einer Supplementierung
Da es sich bei Tryptophan um eine natürliche Aminosäure handelt, ist eine Überdosierung kaum möglich. Denn das Enzym, welches Tryptophan im Körper abbaut, wird von Tryptophan selbst aktiviert.
Die möglichen Nebenwirkungen sind unterschiedlich und können von Person zu Person unterschiedlich ausfallen, wie z. B:
- Schwindel
- Kopfschmerzen
- Übelkeit
- Brechreiz
- Blutdrucksenkung bei Hypertonie;
13. Tryptophan und die Medizin
Neben den bereits genannten Eigenschaften und Einsatzmöglichkeiten von Tryptophan wird der folgende Abschnitt nun in den Bereich der Medizin/Psychologie vorstoßen. Tryptophan hat sich hier bereits einen Namen gemacht.
14. Tryptophan als Schlafmittel
Der Mensch braucht Schlaf. Bei Schlaf handelt es sich um ein unumgängliches Grundbedürfnis wie Essen oder Trinken. Denn ausschließlich im Schlaf ist es dem menschlichen Organismus möglich, sich körperlich und geistig auszuruhen und zu regenerieren. Doch viele Menschen leiden in der heutigen Zeit, die von Hektik geprägt ist, unter Schlafmangel. Sie sind so gestresst, dass es ihnen einfach schwerfällt, abzuschalten und sich auf einen guten Schlaf einzustellen. Dieses Problem in unserer Gesellschaft beschäftigt auch die Wissenschaft.
Im Jahre 2006 konnte der Wissenschaftler Cubero et al., und seine Kollegen als Ergebnis ihrer Studien darstellen, welchen Einfluss das Tryptophan auf den Schlaf besitzt und wie die weitere Verstoffwechslung zu Melatonin im Gehirn abläuft. Seinen Einsatz als Schlafmittel untersuchte Hartmann 1982 genauer. Er fand heraus, dass bereits eine tägliche Dosis von 1 – 1,5 g Tryptophan genügten, damit die Probanden wesentlich schneller müde wurden (30 Minuten nach der Einnahme).
15. Tryptophan und innere Organe
Eine im Jahr 2010 von Cichoz-Lach H. et al., durchgeführte Studie zeigte, dass eine tägliche L-Tryptophangabe, welche sich über 4 Wochen erstreckte, die Lebererkrankung (Steatohepa-titis) erfolgreich eindämmen konnte.
16. Tryptophan in der Muttermilch als Antioxidants
Jede Mutter weiß instinktiv, dass ihre selbst erzeugte Muttermilch das Beste für ihr Neugeborenes ist. Tsopma A. et al. 2009, untersuchten für die Studie eine extra vorbereitete Muttermilch. Ziel war es, festzustellen, welche Inhaltsstoffe die Muttermilch so gut für das Immunsystem macht. Sie kamen zu dem Schluss, dass die antioxidativen Eigenschaften der Muttermilch bestimmten Inhaltsstoffen zu verdanken sind. Einer der hervorstechendsten Inhaltsstoffe war das Tryptophan, das sich in den Tests als extrem starker Radikalfänger herauskristallisierte.
17. Zusammenhang zwischen dem Tryptophanspiegel und Neurodegenerativen Erkrankungen
Wie bereits unter dem Punkt 2 schon dargestellt wurde, ist die Aminosäure Tryptophan der essentielle Grundstoff für die Serotoninsynthese sowie für die Herstellung des Melatonins. Zusätzlich wurde bereits gezeigt, welche Folgen sich ergeben können, wenn ein Mangel an Tryptophan im menschlichen Organismus entsteht. Diese Punkte wurden nochmals kurz angeschnitten, um einen Bezug zu den nun folgenden neurodegenerativen Erkrankung (Depressionen, Demenz etc.) herstellen zu können. Bei einem abfallenden Tryptophanspiegel ist ein geringerer Serotoninspiegel die Folge.
Die dadurch auftretenden Störungen können psychischer Natur sein, wie z.B. Depressionen oder Angstzustände. Sie können sich aber auch als physische Schmerzen wie z.B. Magen-Darm-Schmerzen manifestieren. Die Entstehung von diesen Schmerzen steht in direktem Zusammenhang mit einem erhöhten Abbau eines Zwischenproduktes, welches beim Tryptophanabbau entsteht. Dies geschieht bei der Indolamin-2,3-Dioxygenase.
Hier entstehen Zwischenmetabolite (chemische Zwischenstufen), wie:
- Kynurenin
- Hydroxykynurenin
- Quinilinsäure
Alle 3 Metaboliten, das Kynurenin, die Quinolinsäure und das Hydroxykynurenin, wirken direkt am n-Methyl-D-Aspartat (NMDA)-Rezeptor. Bei allen Schmerzempfindungen spielt der (NMDA)-Rezeptor eine wichtige Schaltstelle.
Als Metabolit des Tryptophanabbaus entsteht Kynurenin. Es handelt sich hier um eine aromatische nicht-proteinogene Aminosäure. Bei der endogenen Synthese von Nicotinsäure und Nicotanimidadenindinukleotid (NAD) ist sie ebenfalls vorzufinden. Des Weiteren ist sie ein NMDA-Gegenspieler, besitzt aber neuroprotektive Eigenschaften.
- Bei Quinolinsäure handelt es sich um einen starken Agonisten des NMDA-Rezeptors.
- Das Hydroxykynurenin dagegen verursacht durch biochemische Vorgänge neurodegenerative Prozesse. Diese Vorgänge führen zu einer Übersteuerung des NMDA-Rezeptors und werden mit Depressionen in Verbindung gebracht.
Wie man anhand der Erklärungen sehen kann, spielen die Metaboliten des Tryptophan eine entscheidende Rolle. Sie können entweder dabei helfen, die neurodegenerativen Erkrankungen zu unterdrücken oder sie fördern deren Entstehung.
18. Fazit und abschließende Worte
Nachdem nun so viele Informationen über Tryptophan gesammelt wurden, ist es an der Zeit, ein Fazit zu ziehen. „Der Vorläufer des „Glückshormons“ Serotonin“ – So lautet der Titel dieses Artikels. Tryptophan nimmt eine entscheidende Funktion als Ausgangssubstrat bei der Biosynthese des Neurotransmitters Serotonin und des Hormones Melatonin ein. Des Weiteren wurde klargestellt, in welchem Zusammenhang Tryptophan mit der Bluthirnschranke (BHS), dem 5-Hydroxythryptophan (5-HTP), dem Serotonin und dem Melatonin steht.
Es wurde deutlich, dass Cashewkerne und Sojabohnen zu den Lebensmitteln zählen, die besonders reich an Tryptophan sind. Tryptophan findet in der Sporternährung als vielversprechende Aminosäure Verwendung, die in Verbindung mit Schlafqualität bzw. Regenerationsprozessen steht und wird auch in der Medizin eingesetzt. Abschließend kann man sagen, dass die Einsatzmöglichkeiten von Tryptophan sicherlich noch nicht ausgeschöpft sind.
Es bleibt abzuwarten, welch spannende Ergebnisse die kommenden Studien noch zu Tage bringen.
Empfehlungen Für Dich
Abonniere jetzt unseren regelmäßig erscheinenden Newsletter und werde stets als Erster über neue Produkte und Angebote informiert.
Der Newsletter ist natürlich jederzeit über einen Link in der E-Mail wieder abbestellbar. Ich habe die Datenschutzbestimmungen zur Kenntnis genommen.


